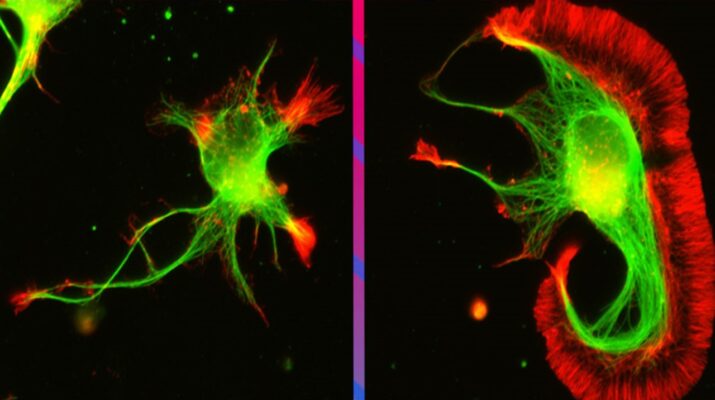
Tres investigadores de CONICET trabajan desde hace años en la interfase entre la neurobiología molecular y la fisicoquímica para poder observar y analizar cada vez con mejor detalle el interior de las neuronas. Recientemente, las revistas Nature Structure and Molecular Biology, Nature Communications y Nano Letters publicaron avances de esta colaboración interdisciplinar.
Los sistemas biológicos se basan en una organización jerárquica de proteínas y otras moléculas que dan origen a organelas, células, tejidos y organismos. La función y la estructura de cada componente se encuentran interrelacionadas por una intrincada red de procesos moleculares como unión, asociación, cambios conformacionales, difusión, reacción, y catálisis. En consecuencia, elucidar los mecanismos que mantienen, modifican o interrumpen la vida requiere de determinar la distribución espacio-temporal y estado funcional de las moléculas constituyentes. Justamente, esta es la misión de los grupos liderados por los investigadores Alfredo Cáceres del Instituto Universitario de Ciencias Biomédicas de Córdoba (IUCBC,) y Damián Refojo, del Instituto de Investigación en Biomedicina de Buenos Aires (IBioBA, CONICET-Partner Institute of the Max Planck Society), que estudian el funcionamiento neuronal a nivel molecular.
La herramienta más comúnmente empleada para visualizar las microestructuras de sistemas biológicos es la microscopía de fluorescencia, porque permite observar por separado o en combinación la organización intracelular de distintas proteínas. Lamentablemente, la microscopía de fluorescencia está lejos de poder brindar resolución molecular. La mínima región que puede distinguirse de otra tiene un tamaño de unos 300 nanometros, donde caben decenas a miles de biomoléculas. La microscopía de superresolución, también conocida como nanoscopía de fluorescencia, está revolucionando la visualización de sistemas biológicos porque mantiene las ventajas de la microscopía de fluorescencia al tiempo que brinda una resolución cinco a cien veces superior. El desarrollo de estas nuevas metodologías es la misión del grupo de Fernando Stefani, investigador del CONICET en el Centro de Investigaciones en Bionanociencias (CIBION, CONICET).
El trabajo interdisciplinar entre los tres grupos permite la formulación de preguntas profundas sobre el funcionamiento neuronal y el desarrollo de nuevas herramientas de visualización con resolución molecular para resolverlas. El fruto de esta sinergia disciplinar se vio recientemente reflejado en tres importantes publicaciones.

.
Interdisciplina en acción, y por triplicado
La primera publicación se realizó en la revista Nature Structure and Molecular Biology en febrero del 2020. Allí se presentó un método desarrollado por el grupo de Refojo que detecta proteínas reguladas por Nedd8, una molécula necesaria tanto para la proliferación celular como para el normal desarrollo de las conexiones sinápticas entre neuronas y los procesos de memoria y aprendizaje. Este desarrollo representa una variante de una metodología llamada espectrometría de masa, mediante la cual los investigadores obtuvieron el primer catálogo con cientos de proteínas neddiladas, es decir, modificadas por el pegado de Nedd8. Ese rastrillaje evidenció que la neddilación en neuronas afectaba fundamentalmente a proteínas del citoesqueleto, fascículos que cumplen funciones estructurales y de transporte esenciales para el desarrollo neuronal. “Con esto proponemos un cambio sustancial en la forma en que se pensó esta modificación molecular hasta hoy”, destaca Damián Refojo y agrega: “Hasta ahora se creía que Nedd8 se unía a un solo tipo de proteínas llamadas Cullinas, que controlan la proliferacion celular. En este trabajo descubrimos que Nedd8, en realidad, se une a cientos de proteínas más para controlar su función, su ubicación subcelular, su estabilidad o su capacidad de formar otros complejos moleculares”. Entre ellas encontramos muchas proteínas del citoesqueleto. Para visualizar los fascículos microscópicos que conforman el citoesqueleto en neuronas, utilizaron la microscopia de superresolución del laboratorio de Fernando Stefani. Fue a partir de esta tecnología que comprobaron que la inhibición de la neddilación alteraba la formación de esos fascículos y, como consecuencia, la maduración neuronal y la formación de dendritas.
El siguiente artículo se publicó en la prestigiosa revista Nature Communications en enero de 2021. Allí se presentó el método de visualización SIMPLER que permite observar sistemas biológicos con un nivel de detalle en 3D mayor al de las nanoscopías convencionales. Gracias a esta tecnología pudieron visualizar distintos complejos supramoleculares del citoesqueleto neuronal, como los anillos de actina/espectrina o microtúbulos individuales. Alfredo Cáceres, experto y pionero mundial en el estudio del citoesqueleto neuronal se entusiasma con esta posibilidad: “SIMPLER nos abre la puerta de ingreso al estudio molecular y en 3D de la estructura interna de las neuronas en condiciones normales y de diversas enfermedades degenerativas. El conocimiento que podemos ganar es impresionante”. Por otra parte, este método no requiere modificaciones en el hardware de microscopios convencionales, por lo que promete ser ampliamente utilizado en cualquier laboratorio que lleve a cabo experimentos de superresolución.
El tercer avance fue presentado en marzo de 2021 en la revista Nano Letters. Allí se detalla un nuevo método para ubicar la posición de dos moléculas interactuando con una precisión cinco veces mayor a la disponible hasta el momento. El método más usado para visualizar interacciones moleculares se basa en un fenómeno de transferencia de energía entre dos moléculas llamado FRET (por Förster Resonance Energy Transfer). Existen innumerables protocolos para obtener imágenes de FRET que reportan interacciones entre diversas moléculas o entre moléculas y su entorno. Sin embargo, hasta ahora, no existía un método de aplicación general para obtener imágenes de FRET con súper-resolución. Esto es exactamente lo que logró el equipo de Fernando Stefani con el apoyo de los grupos de Refojo y Cáceres, abriendo el camino para un enorme abanico de posibilidades para investigar cómo y dónde se producen las interacciones moleculares dentro de las células.
Para los investigadores, la posibilidad de trabajar cercanamente es una oportunidad única que los lleva a un sinfín de nuevas preguntas que son posibles gracias a este dialogo abierto y frecuente entre laboratorios y disciplinas: “La interacción interdisciplinaria es desafiante y divertida, pero además es el camino que debemos seguir para mantener nuestros altos estándares científicos”, señala Damián Refojo. Por su parte, Stefani remarca que “ambas técnicas nos van a permitir hacer estudios antes imposibles. Podremos ver cómo se organizan e interactúan proteínas dentro de las células y esto nos da una ventaja competitiva fundamental para nuestros estudios futuros”. Y agrega que “la dinámica de trabajo entre los tres grupos ha sido extraordinaria, muy estimulante y creativa. Tenemos diez veces más ideas y proyectos de los que podemos realizar. Lo más difícil es priorizar, porque todos los proyectos son de primer nivel.” Finalmente, Cáceres reflexiona: “esta cooperación muestra una manera de trabajar e investigar que rinde. Es la manera en que se está avanzando en los mejores laboratorios del mundo. Las investigaciones de punta requieren de esfuerzos mancomunados y sostenidos entre las disciplinas tradicionales. Nuestro trabajo en conjunto recién comienza.” (CONICET)